Prinsip Pembentukan Molekul - Molekul adalah kumpulan dua atom atau bahkan lebih yang ada didalam suatu susunan tertentu yang terikat oleh gaya kimia atau ikatan kimia. Molekul secara garis besar dibagi menjadi dua yaitu molekul unsur dan molekul senyawa. Contoh molekul unsur pada proses respirasi adalah gas oksigen dengan rumus molekul O2, sedangkan contoh dari molekul senyawa yakni gas karbon dioksida dengan rumus molekul CO2 serta air (H2O).
Prinsip Pembentukan Molekul
Untuk memahami lebih lanjut mengenai prinsip pembentukan molekul ada 3 hal yang harus dikuasi yaitu konfigurasi elektron, ion dan indentifikasi unsur.
Konfigurasi Elektron
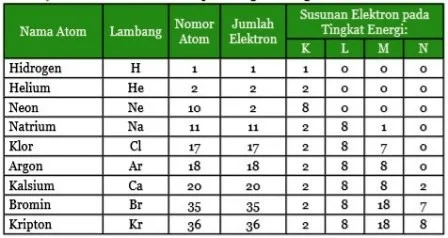
Agar mengetahui bagaimana atom-atom dapat berikatan kamu harus mempelajari susunan elektron di dalam suatu atom atau yang disebut dengan konfigurasielektron. Sebagaiman dijelaskan pada model atom, atom mempunyai tingkat-tingkat energi yang menurut Bohr disebut kulit-kulit atom. Menurut teori mekanika gelombang yaitu teori atom yang digunakan pada saat ini, tingkat-tingkat energi dalam suatu atom berturut-turut adalah tingkat energi K atau n=1, L untuk n=2, M untuk n=3 dan seterusnya.
Agar kamu lebih mudah mempelajari susunan elektron dalam suatu atom, kita gunakan istilah kulit-kulit atom sebagaimana teori Bohr untuk tingkat-tingkat energi. Dengan demikian suatu atom akan mempunyai kulit K (n=1), kulit L (n=2), dan seterusnya. Masingmasing kulit atom ditempati oleh sejumlah elektron. Setiap kulit mempunyai jumlah maksimum elektron yang dapat menempatinya. Misalnya kulit K, maksimum hanya dapat ditempati oleh 2 elektron. Apabila atom tersebut mempunyai elektron lebih dari 2 maka elektron berikutnya akan menempati kulit yang lebih tinggi. Pengisian elektron pada kulit-kulit atom dimulai dari pengisian kulit terdalam atau yang mempunyai energi paling rendah.
Ion
Atom-atom dengan nomor atom 1 sampai 18 akan ada dalam keadaan stabil bila kulit atom terluarnya berisi 2 elektron seperti helium (He) atau 8 elektron seperti neon (Ne), argon (Ar), dan kripton (Kr). Untuk mencapai jumlah 8 elektron, suatu atom dapat melepaskan atau menerima satu atau lebih elektron. Contoh atom natrium (Na) yang mempunyai 11 elektron mempunyai susunan elektron K=2, L=8, dan M=1. Pada konfigurasi seperti ini kulit atom M hanya terisi satu elektron. Keadaan ini menyebabkan natrium (Na) tidak stabil. Agar mempunyai 8 elektron pada kulit terluarnya, atom Na dapat melepaskan satu elektron atau menerima 7 elektron dari atom lain. Tetapi, menerima 7 elektron sangat sulit, maka atom natrium (Na) cenderung melepaskan 1 elektron. Akibatnya, bila Na melepaskan 1 elektron maka ada satu proton di dalam inti atom natrium (Na) yang tidak diseimbangkan oleh elektron. Jadi natrium (Na) akan kelebihan muatan positif dari satu proton.
Pada atom natrium (Na) yang melepaskan satu elektron, atom natrium (Na) yang pada mulanya bersifat netral akan berubah menjadi Na bermuatan +1 yang ditulis Na+. Jenis Na+ tersebut disebut ion Na+. Berdasarkan penjelasan tersebut, apakah kamu dapat menyimpulkan apa itu ion? Ion yang bermuatan positif seperti ion Na+ secara umum disebut kation. Contoh lain adalah atom kalisum (Ca) yang mempunyai susunan elektron dalam atomnya K=2, L=8, M=8, dan N=2. Agar mempunyai 8 elektron pada kulit terluar maka kalisum (Ca) melepaskan dua elektron menjadi ion Ca2+.
Sebaliknya atom klor (17Cl) mempunyai susunan elektron K=2, L=8, dan M=7. Agar atom klor (Cl) stabil maka ditangkaplah satu elektron dari atom lain agar kulit atom M terisi 8 elektron. Atom klor (Cl) yang menerima satu elektron akan kelebihan muatan negatif. Atom klor (Cl) yang pada mulanya bersifat netral mempunyai 17 proton dan 17 elektron, jika menerima satu elektron dari luar maka atom klor (Cl) akan menjadi bermuatan -1 atau ditulis Cl-. Ion yang bermuatan negatif secara umum disebut anion.
Sebuah ion positif (kation) memiliki jumlah elektron lebih sedikit dari proton yang ada pada inti atom, sebaliknya ion negatif (anion) memiliki jumlah elektron lebih banyak dari proton. Dengan kata lain, atom yang melepaskan elektron akan menjadi ion yang bermuatan positif, sedangkan atom yang menerima elektron akan menjadi ion yang bermuatan negatif.
Pada contoh pembentukan garam NaCl, ion Na+ dan ion Cl- tarik-menarik secara elektrostatik membentuk senyawa NaCl yang netral. Senyawa yang terbentuk dari kation dan anion disebut senyawa ionik. Gaya tarik-menarik (gaya elektrostatik) antara kation dan anion dalam senyawa tersebut disebut ikatan ion.
Kebanyakan unsur-unsur di alam berbentuk ion-ion. Seperti garam dapur yang kita konsumsi setiap hari dalam bumbu masakan terbentuk dari interaksi tarik menarik antara ion Na+ dengan ion Cl-. Dengan demikian garam NaCl merupakan senyawa ionik.
Pada senyawa NaCl, kation dan anion tersusun selang-seling secara teratur sedemikian rupa sehingga tarik-menarik antara Na+ dan Cl- terjadi maksimal. Susunan seperti itu disebut dengan istilah kristal. Pada umumnya unsur-unsur dalam bentuk logam cenderung melepaskan elektron, sehingga akan bermuatan positif (membentuk kation), sedangkan unsur non logam akan cenderung menerima elektron sehingga bermuatan negatif (membentuk anion). Kecenderungan suatu atom untuk menerima atau melepas elektron sehingga menjadi stabil juga dapat diketahui dari jumlah elektron terluar. Atom yang memiliki elektron terluar lebih dari 5 cenderung mengikat atau menerima elektron, sedangkan atom yang memiliki elektron kurang dari 4 cenderung melepaskan elektron.
Identifikasi Unsur
Kembang api mengandung senyawa-senyawa tertentu. Bila kembang api dibakar maka molekul yang ada di dalam senyawa tersebut menyerap energi dan menyebabkan elektron-elektron pada atomnya mengalami perpindahan antar kulit atom. Perpindahan elektron dari kulit atom yang lebih rendah ke tinggi akan menyerap energi sedangkan perpindahan elektron dari kulit yang lebih tinggi ke rendah akan melepaskan energi. Energi yang dilepaskan tersebut akan terlihat sebagai cahaya. Masing-masing atom mempunyai jarak antarkulit atom yang berbeda sehingga energi yang diserap atau dilepaskan juga akan berbeda. Perbedaan tersebut menyebabkan terjadinya warna-warna yang berbeda. Jika kamu menyulut kembang api berarti kamu telah melakukan reaksi kimia yang menghasilkan cahaya.






Post a Comment